Expression of CD68 and Fas Ligand in Colon Mucosa of Patients with Inflammatory Bowel Disease as Prognostic Markers of Cancerogenesis
- Authors: Santimov A.V1, Kolobov A.V2, Karev V.E3, Kolobova O.L1, Kostik M.M1, Dubko M.F1, Kalashnikova O.V1, Masalova V.V1, Snegireva L.S1, Volkova N.L1, Khvatov A.A1, Belogurova M.B1, Chasnyk V.G1
-
Affiliations:
- St Petersburg State Pediatric Medical University
- Saint Petersburg State University
- Research Institute of Children Infection Diseases FMBA of Russia
- Issue: Vol 7, No 3 (2016)
- Pages: 42-48
- Section: Articles
- URL: https://journals.rcsi.science/pediatr/article/view/5722
- DOI: https://doi.org/10.17816/PED7342-48
- ID: 5722
Cite item
Full Text
Abstract
Full Text
Введение
Как известно, воспалительные заболевания кишечника (ВЗК), включающие в себя язвенный колит и болезнь Крона, возникают как следствие сложных взаимодействий между генами предрасположенности, окружающей средой и иммунной системой [1, 8].
Клинические особенности заболеваний, гистопатологические находки и терапевтическая эффективность иммуносупрессивных препаратов указывают на участие иммунной системы в патогенезе ВЗК, в который вовлечены ее различные компоненты, такие как антигены в просвете кишечника, кишечные эпителиальные клетки, клетки врожденного и адаптивного иммунитета и секретируемые ими медиаторы [22]. У пациентов с ВЗК повышен риск возникновения рака толстой кишки. Впервые сообщение о выявлении связи рака толстой кишки с язвенным колитом еще в 1925 г. опубликовали B. Crohn, H. Rosenberg [9]. В последующем многочисленные эпидемиологические исследования подтвердили повышенный риск возникновения рака при язвенном колите [12].
Исследований, посвященных изучению связи болезни Крона и рака толстой кишки, проводилось меньше, и на протяжении многих лет считалось, что пациенты с болезнью Крона не имеют повышенного риска развития рака. Первая статистическая оценка риска возникновения рака толстой кишки при болезни Крона была дана в 1973 г. D.D. Weedon et al. на примере группы из 449 пациентов с болезнью Крона [25]. Рак был диагностирован у 12 пациентов (7 случаев рака ободочной кишки, 1 — прямой кишки, 1 — тонкой кишки и 3 — другой локализации). Возраст половины пациентов на момент диагностики рака колебался в диапазоне от 20 до 38 лет. Длительность течения болезни Крона на момент диагностики рака толстой кишки составляла 7–45 лет. Данное исследование показало, что заболеваемость раком толстой кишки у пациентов с болезнью Крона в 20 раз выше, чем в контрольной группе идентичных по полу и возрасту индивидов из общей популяции [25].
В настоящее время считается, что вероятность возникновения рака толстой кишки составляет 5,5–13,5 % у пациентов с язвенным колитом и 0,4–0,8 % — у пациентов с болезнью Крона [20]. Примерная кумулятивная заболеваемость раком толстой кишки у пациентов с левосторонним язвенным колитом или панколитом составляет 2 % после 10 лет, 8 % после 20 лет и 18 % после 30 лет продолжительности заболевания [12]. Рак толстой кишки при болезни Крона наблюдается примерно в те же сроки, что и при язвенном колите. Средняя длительность заболевания на момент диагностики рака толстой кишки сопоставима для болезни Крона и язвенного колита (15 и 18 лет соответственно). Средний возраст на момент постановки диагноза рака толстой кишки составляет 55 лет при болезни Крона и 43 года при язвенном колите [8].
В ходе популяционного когортного исследования, включавшего 19 876 пациентов с язвенным колитом или болезнью Крона, было установлено, что около 10 % всех случаев ВЗК-ассоциированного рака толстой кишки было выявлено у пациентов с семейным анамнезом колоректального рака. Аналогичная ассоциация имеется и у здоровых людей, хотя у пациентов с воспалительными заболеваниями кишечника семейный анамнез колоректального рака приводит к удвоению уже повышенного риска рака толстой кишки [4].
Риск рака толстой кишки через 35 лет после постановки диагноза язвенного колита составляет 40 % для пациентов моложе 15 лет на момент дебюта. В каждой последующей возрастной группе на момент постановки диагноза (15–29 лет, 30–39 лет, 40–49 лет, 50–59 лет и старше 60 лет) относительный риск рака толстой кишки снижается примерно наполовину [12].
Увеличенный риск возникновения рака у пациентов с ВЗК, особенно у заболевших в детском возрасте, является основанием для включения регулярного углубленного онкологического обследования в планы последующего мониторинга таких больных. Морфологическая идентификация дисплазии в биоптатах слизистой — самый лучший и наиболее надежный маркер увеличенного риска рака у пациентов с воспалительными заболеваниями кишечника, и это формирует основание для рекомендации наблюдательной эндоскопической тактики у пациентов с язвенным колитом и болезнью Крона [18].
Известно, что болезнь Крона ассоциируется с повышенным количеством макрофагов, в частности макрофагов CD68(+) [8], в слизистой оболочке толстой и подвздошной кишки [21].
CD68 представляет собой трансмембранный гликопротеин, который экспрессируется тканевыми макрофагами и моноцитами. Являясь интегральным белком I типа с высокогликозилированным внеклеточным доменом, связанным с ткане- и органоспецифичными лектинами или селектинами, он относится к семейству лизосомально-эндосомальных мембраноассоциированных белков, преимущественно локализованных в лизосомах и эндосомах, и представляет собой скавенджер-рецептор, способствующий устранению продуктов клеточного распада, фагоцитозу и опосредующий активацию макрофагов [14].
Fas-лиганд (FasL) — трансмембранный протеин, принадлежащий к суперсемейству фактора некроза опухоли, который вызывает апоптоз после сшивки с рецептором Fas (CD95/Apo-1). Fas экспрессируют различные клетки, в то время как FasL экспрессируется преимущественно в активированных Т-клетках. Fas и FasL участвуют в регуляции иммунных реакций, а также в Т-клеточно-опосредованной цитотоксичности.
При колоректальном раке, как и при многих других опухолях, отмечается повышенная экспрессия FasL [26]. Более того, существует гипотеза, что клетки, экспрессирующие FasL, способны убивать Fas-экспрессирующие активированные лимфоциты и избегать отторжения иммунной системой, что может быть молекулярной основой для различий в ассоциации язвенного колита и болезни Крона с раком толстой кишки [17].
Цель исследования
Оценить целесообразность использования количества макрофагов CD68(+) и экспрессии Fas-лиганда в слизистой оболочке толстой кишки у пациентов с язвенным колитом, болезнью Крона и раком толстой кишки для прогнозирования риска канцерогенеза при ВЗК.
Материалы и методы
Использовались биоптаты толстой кишки, полученные при проведении колоноскопии у 10 пациентов в возрасте от 3 до 17 лет с ВЗК (4 — язвенный колит, 6 — болезнь Крона) и участки толстой кишки 17 пациентов в возрасте от 30 до 83 лет, оперированных по поводу рака толстой кишки. Диагноз был установлен на основании общепринятых клинических, эндоскопических, рентгенологических и гистологических критериев.
Изучение экспрессии CD68 (КР1 clone, Dako, 1 : 50) и FasL (Diagnostic BioSystems, 1 : 75) осуществлялось иммуногистохимическим методом на препаратах, приготовленных из образцов, полученных из пораженных участков толстой кишки у 10 пациентов с ВЗК и 10 пациентов с раком толстой кишки, а также из образцов, полученных из непораженных участков толстой кишки у 7 пациентов с раком толстой кишки. Иммуногистохимическая реакция проводилась согласно стандартному одноэтапному протоколу с высокотемпературной демаскировкой антигенов.
Морфометрическое исследование осуществлялось с помощью системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Leica DMR, цифровой камеры Leica DC300, персонального компьютера на базе Intel core i3 и программы Leica QWin. В каждом случае анализировалось 5 полей зрения при увеличении × 400, определялась относительная площадь экспрессии сигнальных молекул (см. рис. 1), которая представляет собой отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения, выражаемое в процентах. При статистической обработке использовали T-критерий Фишера – Стьюдента (Statistica 9, StatSoft).
Рис. 1. Экспрессия FasL (иммуногистохимический анализ, Diagnostic BioSystems, 1 : 75) в одном поле зрения препарата слизистой толстой кишки (× 400)
Результаты
Полученные результаты представлены в таблице 1 и на рисунках 2, 3.
Несмотря на выявленную отчетливую тенденцию (р = 0,06) к увеличению числа макрофагов CD68(+) у пациентов с язвенным колитом (4,55) при сравнении с непораженными участками кишки у пациентов с раком толстой кишки (2,88), мы в целом не обнаружили существенных различий в средней площади экспрессии CD68 в слизистой кишки при исследованных заболеваниях, в том числе при сравнении препаратов слизистой у пациентов с язвенным колитом и болезнью Крона (4,55, 3,26 соответственно, р = 0,019) и при сравнении препаратов пораженной и непораженной слизистой (3,20, 2,88 соответственно, р = 0,59) при раке кишки (см. табл. 1, рис. 2).
Анализ результатов, полученных при исследовании экспрессии FasL, привел к следующим выводам (см. табл. 1, рис. 3).
Существенных различий в средней экспрессии Fas-лиганда в лимфоцитах у пациентов с язвенным колитом (0,33) и болезнью Крона (0,25) нет (р = 0,17).
Существенных различий в средней экспрессии Fas-лиганда в лимфоцитах слизистой пораженных (0,77) и непораженных (0,53) участках кишки при раке нет (р = 0,16).
Средняя экспрессия Fas-лиганда как в непораженных (0,53), так и пораженных (0,77) участках кишки пациентов с раком толстой кишки была выше (р = 0,036, р = 0,001 соответственно), чем у пациентов с болезнью Крона (0,25).
Таблица 1 Средние значения (М) и средняя ошибка средних значений (m) площади экспрессии сигнальных молекул в слизистой кишки при исследованных заболеваниях
Патология | CD68 | FasL | ||
М | m | М | m | |
Болезнь Крона | 3,256 | 0,341 | 0,252* | 0,030 |
Язвенный колит | 4,549 | 1,067 | 0,333** | 0,056 |
Рак, пораженная слизистая | 3,198 | 0,452 | 0,774 | 0,117 |
Рак, непораженная слизистая | 2,881 | 0,235 | 0,531 | 0,118 |
Болезнь Крона + язвенный колит | 3,773 | 0,476 | 0,284*** | 0,029 |
Рак, пораженная слизистая + рак, непораженная слизистая | 3,067 | 0,284 | 0,675 | 0,085 |
* Меньше, чем при раке (непораженная слизистая, p = 0,036; пораженная слизистая, р = 0,001). ** Меньше, чем при раке (пораженная слизистая, р = 0,023). *** Меньше, чем при раке (непораженная слизистая, р = 0,020; пораженная слизистая, р = 0,000; пораженная + непораженная, р = 0,001) | ||||
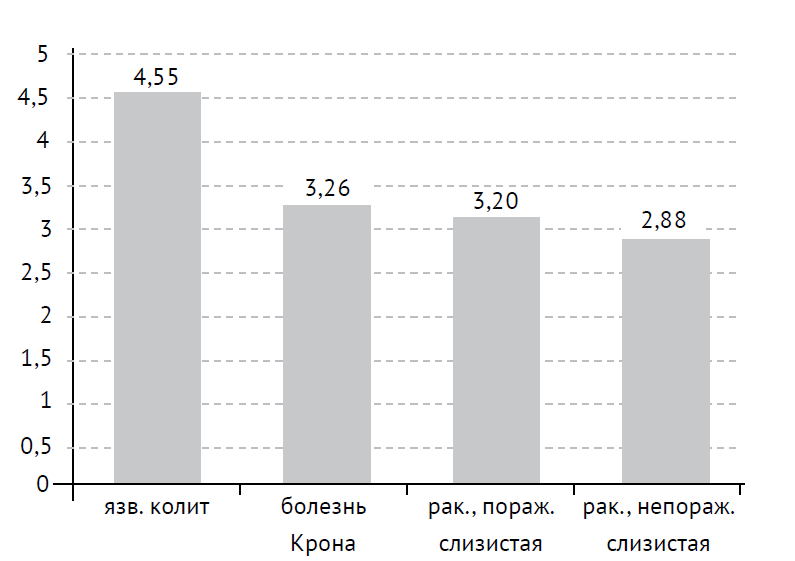
Рис. 2. Экспрессия CD68 в слизистой толстой кишки при исследованных заболеваниях
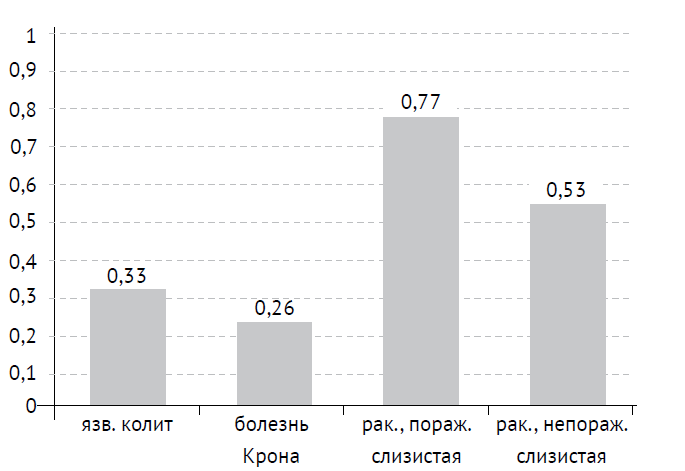
Рис. 3. Экспрессия FasL в слизистой толстой кишки при исследованных заболеваниях
Средняя экспрессия Fas-лиганда в пораженных участках кишки у пациентов с раком толстой кишки (0,77) была выше (р = 0,023), чем у пациентов с язвенным колитом (0,33).
Интерес представляют результаты, полученные при включении в число сравниваемых объединенных групп «болезнь Крона + язвенный колит» (ВЗК) и «рак, неповрежденная слизистая + рак, поврежденная слизистая» (рак) (см. табл. 1). Экспрессия FasL при ВЗК существенно (р = 0,001) ниже (0,28), чем при раке (0,68), в то время как различий в экспрессии CD68 нет (3,77, 3,07 соответственно, р = 0,18).
Обсуждение
Наши результаты подтвердили наличие одинаково большого количества макрофагов CD68+ в слизистой пациентов с ВЗК и раком толстой кишки.
Ранее [2, 3, 9, 15] при определении клеточного состава в образцах толстой кишки при болезни Крона было зарегистрировано увеличение моноцитарно-макрофагальной инфильтрации, в частности большое количество макрофагов CD68+. Подобная закономерность была выявлена и при изучении стромы опухоли при раке толстой кишки [6, 7, 27], причем, по общепринятому мнению, опухоль-ассоциированные макрофаги усиливают опухолевую прогрессию путем обеспечения опухолевой инвазии, миграции и ангиогенеза [21].
Пожалуй, наиболее интересные результаты, на наш взгляд, были получены при исследовании экспрессии FasL.
Известно, что неисправности Fas-системы обусловливают лимфопролиферативные расстройства и аутоиммунные заболевания, а ее усиление может вызвать деструкцию ткани [16]. Было показано, что FasL высоко экспрессируется в пораженных участках слизистой у пациентов с активным язвенным колитом, но не у пациентов с болезнью Крона, что отражает одно из различий в патогенезе двух ВЗК (при болезни Крона основную роль играют макрофаги, но не цитотоксические Т-лимфоциты) [24], а апоптоз играет роль при болезни Крона, но в пораженных участках кишки он опосредован не Fas-FasL-системой, а в том числе матриксной металлопротеиназой-1 [11].
Полученные результаты свидетельствуют о перспективности оценки экспрессии CD68 и Fasl в слизистой кишечника больных ВЗК не только для оценки вероятности канцерогенеза, но и для оптимизации программ терапии с использованием генно-инженерных препаратов.
В настоящее время доказано, что фактор некроза опухоли — альфа (TNFα), в продукции которого принимают участие лимфоциты, моноциты и макрофаги [19], является одним из ключевых факторов патогенеза болезни Крона, что наглядно иллюстрируется общеизвестной высокой эффективностью применения препаратов анти-TNFα в его лечении [5]. Помимо своей роли в производстве TNFα макрофаги являются важным звеном в механизме формирования местного иммунитета слизистых оболочек, включая презентацию антигена и повышение продукции иммуноглобулинов [10].
Выводы
- Выявленные ассоциации свидетельствуют о целесообразности использования экспрессии CD68 и FasL в качестве прогностических маркеров трансформации ВЗК в рак толстой кишки и в оптимизации программ терапии ВЗК с использованием генно-инженерных препаратов.
- В основу прогноза канцерогенеза может быть положено наличие повышенной экспрессии CD68 и FasL в слизистой толстой кишки больных ВЗК.
- Для подтверждения полученных результатов и разработки прогностических решающих правил необходимо проведение более масштабных исследований.
About the authors
Andrey V Santimov
St Petersburg State Pediatric Medical University
Author for correspondence.
Email: a.santimoff@gmail.com
MD, Research Fellow, Department of Hospital Pediatrics Russian Federation
Andrey V Kolobov
Saint Petersburg State University
Email: pathandrey@rambler.ru
MD, PhD, Associate Professor, Department of Pathology Russian Federation
Vadim E Karev
Research Institute of Children Infection Diseases FMBA of Russia
Email: karev@fromru.com
MD, PhD, Head of the Lab of Pathomorphology Russian Federation
Oksana L Kolobova
St Petersburg State Pediatric Medical University
Email: aksjutakolobova@rambler.ru
MD, PhD, Associate Professor, Department of Hospital Pediatrics Russian Federation
Mikhail M Kostik
St Petersburg State Pediatric Medical University
Email: kost-mikhail@yandex.ru
MD, PhD, Associate Professor, Department of Hospital Pediatrics Russian Federation
Margarita F Dubko
St Petersburg State Pediatric Medical University
Email: mf-dubko@yandex.ru
MD, PhD, Associate Professor, Department of Hospital Pediatrics Russian Federation
Olga V Kalashnikova
St Petersburg State Pediatric Medical University
Email: koira7@yandex.ru
MD, PhD, Associate Professor, Department of Hospital Pediatrics Russian Federation
Vera V Masalova
St Petersburg State Pediatric Medical University
Email: masalova.vera@gmail.com
Assistant Professor, Department of Hospital Pediatrics Russian Federation
Lyudmila S Snegireva
St Petersburg State Pediatric Medical University
Email: l.s.snegireva@mail.ru
MD, Department of Pediatrics No 3 Russian Federation
Natalia L Volkova
St Petersburg State Pediatric Medical University
Email: volkovanatalia.dr@yandex.ru
MD, Head of Department. Department of Gastroenterology Russian Federation
Andrey A Khvatov
St Petersburg State Pediatric Medical University
Email: andrey_hvatov@mail.ru
Assistant Professor, Department of Oncology. Russian Federation
Margarita B Belogurova
St Petersburg State Pediatric Medical University
Email: deton.hospital31@inbox.ru
MD, PhD, Dr Med Sci, Professor, Head of the Department of Oncology Russian Federation
Vyacheslav G Chasnyk
St Petersburg State Pediatric Medical University
Email: chasnyk@gmail.com
MD, PhD, Dr Med Sci, Professor, Head of the Department of Hospital Pediatrics Russian Federation
References
- Залетова Н.К., Чухловин А.Б., Третьяк А.Т., и др. Генетические факторы, влияющие на эффективность терапии глюкокортикоидами при хронических воспалительных заболеваниях кишечника у детей // Педиатр. — 2015. — Т. 4. — № 3. — С. 91–97. [Zaletova NK, Chukhlovin A B, Tretjak AT, et al. Genetic factors modifying response to glucocorticoid treatment in chronic pediatric inflammatory bowel diseases. Pediatr (St Petersburg). 2015;4(3):91-97 (In Russ).]
- Маркова Д.О., Ревнова М.О., Насыров Р.А. Цитомегаловирусная инфекция у больных с воспалительными заболеваниями кишечника // Педиатр. — 2013. — Т. 4. — № 1. — С. 95–99. [Markova DO, Revnova MO, Nasyrov RA. Cytomegalovirus infection in the patients with in FLammatory bowel disease. Pediatr (St Petersburg). 2013;4 (1):95-99. (In Russ).].
- Allen C, Hogg N. Elevation of infiltrating mononuclear phagocytes in human colorectal tumors. J Natl Cancer Inst. 1987 Mar;78(3):465-70.
- Askling J, Dickman PW, Karlén P, et al. Family history as a risk factor for colorectal cancer in inflammatory bowel disease. Gastroenterology. 2001 May;120(6):1356-62. doi: 10.1053/gast.2001.24052.
- Bell S, Kamm MA. Antibodies to tumour necrosis factor alpha as treatment for Crohn’s disease. Lancet. 2000 Mar 11;355(9207):858-60. doi: 10.1016/S0140-6736(99)00442-0.
- Bingle L, Brown NJ, Lewis CE. The role of tumour-associated macrophages in tumour progression: implications for new anticancer therapies. J Pathol. 2002 Mar;196(3):254-65. doi: 10.1002/path.1027.
- Chaput N, Svrcek M, Aupérin A, et al. Tumour-infiltrating CD68+ and CD57+ cells predict patient outcome in stage II-III colorectal cancer. Br J Cancer. 2013 Aug 20;109(4):1013-22. doi: 10.1038/bjc.2013.362. Epub 2013 Jul 18.
- Choi PM, Zelig MP. Similarity of colorectal cancer in Crohn’s disease and ulcerative colitis: implications for carcinogenesis and prevention. Gut. 1994; 35:950-4. doi: 10.1136/gut.35.7.950.
- Crohn B, Rosenberg H. The sigmoidoscopic picture of chronic ulcerative colitis (non-specific). Am J Med Sci. 1925;170:220-8. doi: 10.1097/00000441-192508010-00006.
- Demetter P, De Vos M, Van Huysse JA, et al. Colon mucosa of patients both with spondyloarthritis and Crohn’s disease is enriched with macrophages expressing the scavenger receptor CD163. Ann Rheum Dis. 2005 Feb;64(2): 321-4. Epub 2004 May 27. doi: 10.1136/ard.2003.018382.
- Di Sabatino A, Ciccocioppo R, Luinetti O, et al. Increased enterocyte apoptosis in inflamed areas of Crohn’s disease. Dis Colon Rectum. 2003 Nov;46(11):1498-507. doi: 10.1007/s10350-004-6802-z.
- Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcera- tive colitis: a meta-analysis. Gut. 2001;48:526-35. doi: 10.1136/gut.48.4.526.
- Ekbom A, Helmick C, Zack M, Adami H. Increased risk of large-bowel cancer in Crohn’s disease with colonic involvement. Lancet. 1990;336:357-9. doi: 10.1016/0140-6736(90)91889-I.
- Holness CL, Simmons DL. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins. Blood. 1993 Mar 15;81(6):1607-13.
- Liu S, Russo PA, Baldassano RN, Sullivan KE. CD68 expression is markedly different in Crohn’s disease and the colitis associated with chronic granulomatous disease. Inflamm Bowel Dis. 2009 Aug;15(8):1213-7. doi: 10.1002/ibd. 20890.
- Nagata S, Golstein P. The Fas death factor. Science. 1995 Mar 10;267(5203):1449-56. doi: 10.1126/science.7533326.
- O’Connell J, Bennett MW, O’Sullivan GC, et al. The Fas counterattack: cancer as a site of immune privilege. Immunol Today. 1999 Jan; 20(1):46-52. doi: 10.1016/S0167-5699(98)01382-6.
- Odze RD. Pathology of dysplasia and cancer in inflammatory bowel disease. Gastroenterol Clin North Am. 2006;35:533. doi: 10.1016/j.gtc.2006.07.007.
- Pennica D, Nedwin GE, Hayflick JS, et al. Human tumour necrosis factor: precursor structure, expression and homology to lymphotoxin. Nature. 1984 Dec 20-1985 Jan 2;312(5996):724-9.
- Pohl C, Hombach A, Kruis W. Chronic inflammatory bowel disease and cancer. Hepatogastroenterology. 2000 Jan-Feb;47(31):57-70.
- Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis. Nat Rev Cancer. 2004 Jan;4(1):71-8. doi: 10.1038/nrc1256.
- Shih DQ, Targan SR. Immunopathogenesis of inflammatory bowel disease. World J Gastroenterol. 2008 Jan 21;14(3):390-400. doi: 10.3748/wjg. 14.390.
- Thyberg J, Graf W, Klingenström P. Intestinal fine structure in Crohn’s disease. Lysosomal inclusions in epithelial cells and macrophages. Virchows Arch A Pathol Anat Histol. 1981;391(2):141-52. doi: 10.1007/BF00437592.
- Ueyama H, Kiyohara T, Sawada N, et al. High Fas ligand expression on lymphocytes in lesions of ulcerative colitis. Gut. 1998 Jul;43(1):48-55. doi: 10.1136/gut.43.1.48.
- Weedon DD, Shorter RG, Ilstrup DM, et al. Crohn’s disease and cancer. N Engl J Med. 1973 Nov 22;289(21):1099-103. doi: 10.1056/NEJM197311222892101.
- Zhang W, Ding EX, Wang Q, et al. Fas ligand expression in colon cancer: a possible mechanism of tumor immune privilege. World J Gastroenterol. 2005 Jun 21;11(23):3632-5. doi: 10.3748/wjg.v11.i23.3632.
- Zhang Y, Sime W, Juhas M, Sjölander A. Crosstalk between colon cancer cells and macrophages via inflammatory mediators and CD47 promotes tumour cell migration. Eur J Cancer. 2013 Oct;49(15):3320-34. doi: 10.1016/j.ejca.2013.06.005. Epub 2013
Supplementary files







